Zusammenfassung
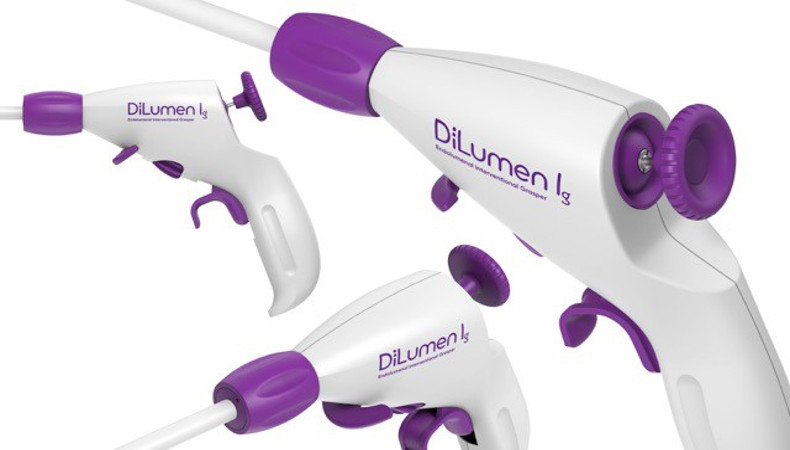
FDA: Wir freuen uns über die FDA-Freigabe unserer zweiten DiLumen Produktgeneration, DiLumen Is™ Endolumenal Interventional Scissors (Schere).
Dies bedeutet für uns die Freigabe der Amerikanischen Gesundheitsbehörde (auch FDA 510(k) Clearance genannt) für den US-amerikanischen Markt.
Im Dezember 2016 haben wir Sie informiert, dass die FDA unser Eingabe für das DiLumen Produkt freigegeben hat.
1 Jahr später sprach unser Vorstandsvorsitzende, Dr. Peter Johann, in einem Video über unsere Pläne für 2018 und im April 2018 informierten wir Sie über die FDA 510(k) Freigabe für DiLumen C2.
Wir entwickeln unsere Technologie für minimalinvasive gastrointestinale Chirurgie laufend weiter. Aus diesem Grunde können wir Ihnen nun mitteilen, dass wir für DiLumen Is™ Endolumenal Interventional Scissors (Schere) ebenfalls die FDA-Freigabe erhalten haben. Diese elektroangetriebene Schere ist für den einmaligen Gebrauch beim Sezieren und Ausbrennen von Gewebe im Verdauungstrakt mit Hilfe von endoskopischen Verfahren geeignet.
Die Pressemitteilung zur 510(k) Clearance können Sie hier herunter laden als PDF Datei.
Medical Advisor Meeting in Mailand
Im Monat Mai 2018 hatten wir ebenfalls einen kleinen Kongress für Ärzte und weitere Experten in Mailand.
Die Handlingstests wurden bei der medizinischen Fakultät der Humanitas University in Mailand durchgeführt. Dabei standen uns 4 Stationen mit vollständigem OP-Equipment zur Verfügung.
Sergey Kantsevoy, M.D., Director, The Center for Therapeutic Endoscopy berichtete von seinen zahlreichen erfolgreichen Anwendungen von DiLumen Produkten mit Patienten in Baltimore (USA).

Prof. Repici hat die Diskussion unter den Fachärzten geleitet und die Anwendung und den operativen Nutzen von DiLumen bei Endoscopic Submucosal Dissection (ESD) diskutiert.

Das Feedback nach dem Lab war äußerst gut. Die Ärzte sehen die Vorteile im Handling von komplizierten Eingriffen und möchten DiLumen bei Ihren Patienten anwenden.

Das obige Video gibt es auf LinkedIn.
3. Was ist Ihre Meinung?
Ihre Meinung interessiert uns. Was denken Sie?
- Als Lumendi Investor, wie sehen Sie den Weg nach vorn?
- Als Endoskopiker oder Chirurg, sind Sie an einer Testfahrt mit unserem Produkt bei der Durchführung eines mimimalinvasiven endoskopischen Eingriffes interessiert? Wenn die Antwort ja ist, bitte lassen Sie es uns in einem Kommentar unten wissen.
- Haben Sie Fragen? Wir freuen uns von Ihnen zu hören!
Gut zu Wissen
Freigabe, d.h. “Clearance” wird nach FDA von der regulatorischen Genehmigung oder “approval” unterschieden. Es ist aber ebenfalls sehr wichtig. Um die 510(k) Freigabe zu erhalten, verlangt die FDA keine klinischen Untersuchungen oder Tests mit Patienten, um die Sicherheit und Wirksamkeit des Produktes zu beweisen. Doch das Gerät muss mindestens so sicher und effektiv sein, wie ein vergleichbares Produkt, das bereits auf dem Markt ist.
Der Hersteller eines 510(k) Gerätes muss beweisen, dass das Gerät für die gleiche Anwendung oder Verwendungszweck substanziell äquivalent ist zu einem ähnlichen, schon legal auf dem Markt erhältlichen Produkt.
Das macht den Freigabeprozess einfacher und schneller, aber nicht weniger wichtig für die öffentliche Sicherheit. Es bedeutet ebenfalls, dass die Freigabe zu bekommen eine nicht zu unterschätzende Leistung und damit ein großer Erfolg für das Unternehmen darstellt!
Lesen Sie mehr über diese Arbeit hier.